A hemoglobina (Hb) é uma metaloproteína que contém ferro e é encontrada em abundância nos glóbulos vermelhos de praticamente todos os vertebrados. Ela é frequentemente considerada a "molécula vital" por seu papel indispensável na respiração. Essa proteína complexa é responsável pela tarefa crucial de transportar oxigênio dos pulmões para todos os tecidos do corpo e facilitar o retorno do dióxido de carbono para excreção. Compreender sua função, os mecanismos elegantes que regem seu comportamento e a importância fundamental de sua mensuração clínica oferece uma visão sobre a saúde e as doenças humanas.
Função e Mecanismo: Uma Obra-Prima da Engenharia Molecular
A principal função da hemoglobina é o transporte de gases. No entanto, ela não desempenha essa função como uma simples esponja passiva. Sua eficiência provém de um design estrutural sofisticado e de mecanismos regulatórios dinâmicos.
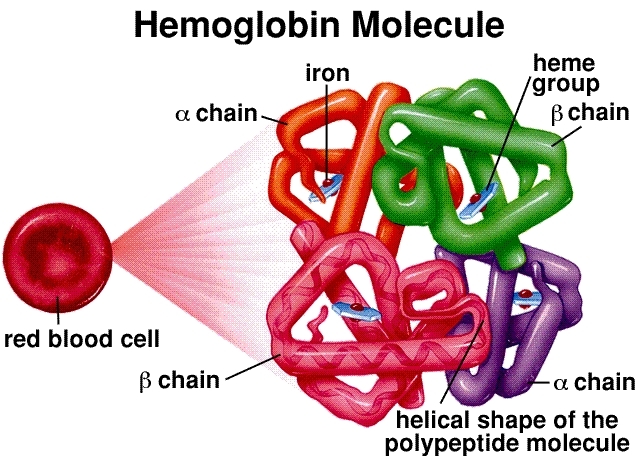
Estrutura Molecular: A hemoglobina é um tetrâmero, composto por quatro cadeias proteicas de globina (duas alfa e duas beta em adultos). Cada cadeia está associada a um grupo heme, uma estrutura complexa em anel com um átomo de ferro central (Fe²⁺). Este átomo de ferro é o sítio de ligação para uma molécula de oxigênio (O₂). Uma única molécula de hemoglobina pode, portanto, transportar no máximo quatro moléculas de oxigênio.
Ligação Cooperativa e a Curva Sigmoidal: Este é o princípio fundamental da eficiência da hemoglobina. Quando a primeira molécula de oxigênio se liga a um grupo heme nos pulmões (onde a concentração de oxigênio é alta), ela induz uma mudança conformacional em toda a estrutura da hemoglobina. Essa mudança facilita a ligação das duas moléculas de oxigênio subsequentes. A quarta e última molécula de oxigênio se liga com a maior facilidade. Essa interação “cooperativa” resulta na curva de dissociação do oxigênio sigmoidal (em forma de S) característica. Essa forma em S é crucial — significa que, no ambiente rico em oxigênio dos pulmões, a hemoglobina se satura rapidamente, mas nos tecidos pobres em oxigênio, ela pode liberar uma grande quantidade de oxigênio com apenas uma pequena queda na pressão.
Regulação alostérica: A afinidade da hemoglobina pelo oxigênio não é fixa; ela é finamente ajustada pelas necessidades metabólicas dos tecidos. Isso é alcançado por meio de efetores alostéricos:
Efeito Bohr: Em tecidos ativos, a alta atividade metabólica produz dióxido de carbono (CO₂) e ácido (íons H⁺). A hemoglobina percebe esse ambiente químico e responde diminuindo sua afinidade pelo oxigênio, o que leva a uma liberação mais abundante de O₂ exatamente onde é mais necessário.
2,3-Bisfosfoglicerato (2,3-BPG): Este composto, produzido nos glóbulos vermelhos, liga-se à hemoglobina e estabiliza seu estado desoxigenado, promovendo ainda mais a liberação de oxigênio. Os níveis de 2,3-BPG aumentam em condições de hipóxia crônica, como em grandes altitudes, para melhorar o fornecimento de oxigênio.
Transporte de dióxido de carbono: A hemoglobina também desempenha um papel vital no transporte de CO₂. Uma pequena, porém significativa, porção de CO₂ se liga diretamente às cadeias de globina, formando carbaminohemoglobina. Além disso, ao tamponar os íons H⁺, a hemoglobina facilita o transporte da maior parte do CO₂ como bicarbonato (HCO₃⁻) no plasma.
A importância crucial dos testes de hemoglobina
Dada a importância central da hemoglobina, medir sua concentração e avaliar sua qualidade é um pilar fundamental da medicina moderna. O exame de hemoglobina, frequentemente incluído no hemograma completo, é um dos exames clínicos mais solicitados. Sua importância é inegável pelos seguintes motivos:
Monitoramento da progressão da doença e tratamento:
Para pacientes diagnosticados com anemia, medições seriadas de hemoglobina são essenciais para monitorar a eficácia do tratamento, como a suplementação de ferro, e para acompanhar a progressão de doenças crônicas subjacentes, como insuficiência renal ou câncer.
Detecção de hemoglobinopatias:
Testes especializados de hemoglobina, como a eletroforese de hemoglobina, são usados para diagnosticar distúrbios genéticos hereditários que afetam a estrutura ou a produção da hemoglobina. Os exemplos mais comuns são a doença falciforme (causada por uma variante defeituosa da HbS) e a talassemia. A detecção precoce é vital para o tratamento e o aconselhamento genético.
Avaliação da policitemia:
Um nível anormalmente alto de hemoglobina pode indicar policitemia, uma condição na qual o corpo produz glóbulos vermelhos em excesso. Isso pode ser um distúrbio primário da medula óssea ou uma resposta secundária à hipóxia crônica (por exemplo, em doenças pulmonares ou em grandes altitudes) e acarreta risco de trombose.
Triagem e Avaliação Geral da Saúde: O teste de hemoglobina faz parte da rotina do pré-natal, dos exames pré-cirúrgicos e dos exames de bem-estar geral. Ele serve como um indicador abrangente da saúde geral e do estado nutricional.
Controle do Diabetes: Embora não seja o padrão ouro para o exame de hemoglobina, o teste de Hemoglobina Glicada (HbA1c) mede a quantidade de glicose que se ligou à hemoglobina. Ele reflete os níveis médios de açúcar no sangue nos últimos 2 a 3 meses e é considerado o padrão ouro para o controle glicêmico a longo prazo em pacientes diabéticos.
Conclusão
A hemoglobina é muito mais do que uma simples transportadora de oxigênio. É uma máquina molecular de design requintado, que emprega ligações cooperativas e regulação alostérica para otimizar o fornecimento de oxigênio em resposta às necessidades dinâmicas do organismo. Consequentemente, a medição clínica da hemoglobina não se resume a um número em um laudo laboratorial; trata-se de uma ferramenta diagnóstica e de monitoramento poderosa e não invasiva. Ela fornece um retrato indispensável da saúde hematológica e geral de uma pessoa, possibilitando o diagnóstico de condições que alteram a vida, o monitoramento de doenças crônicas e a preservação da saúde pública. Compreender tanto sua genialidade biológica quanto sua importância clínica ressalta por que essa humilde proteína permanece um pilar da ciência fisiológica e médica.
Data da publicação: 17/10/2025